茨城大学大学院理工学研究科(理学野)の高妻孝光教授、山口峻英助教、森聖治教授と、信州大学のタボロシ・アティラ助教(研究当時は茨城大学の博士研究員)の研究グループは、さまざまな生命現象の解明や医薬品の薬剤分子設計で重要となる非共有結合性の弱い化学的相互作用(*1)がタンパク質の性質にもたらす影響について、X 線結晶構造解析と量子化学計算によって、定量的に評価することに成功しました。
研究グループはまず、ブルー銅タンパク質の第二配位圏(*2)のアミノ酸残基を人工的に置き換えたシュウドアズリン(銅タンパク質の一種)の変異体の構造を X 線結晶構造解析によって高精度に決定しました。さらに、置き換えられたアミノ酸残基の種類によって、第二配位圏に S-π 相互作用、π-π相互作用、CH-π 相互作用が生じることを量子化学計算から明らかにし、これらの相互作用がシュウドアズリンの性質をコントロールしていることを定量的に示しました。
弱い化学的相互作用の理解が進むことで、医薬品等の効果的・効率的な設計につながることが期待されます。また、第二配位圏の影響を定量的に評価した結果は、人工金属酵素や金属錯体触媒などの開発に対しても分子設計指針を与えるものです。
この成果は、国際学術雑誌である Journal of Inorganic Biochemistry に掲載されました。
背景
細胞の中で起こる化学反応を理解することは、病気の治療や予防、医薬品の開発において重要です。中でも非共有結合性の弱い化学的相互作用は、免疫応答の一部である抗原抗体反応をはじめとして、細胞内でおこる化学反応に重要な役割を果たしています。そのため、タンパク質における弱い化学的相互作用を理解することは、生命現象の解明や、安全で有効な医薬品の効率的設計・開発の鍵となります。
このような弱い化学的相互作用はタンパク質分子に集積していますが、強固な共有結合を骨格として10000 個以上の原子によって形成されている巨大なタンパク質分子の中から、特定の弱い化学的相互作用だけに注目し、さらにその効果を明らかにすることは困難です。そこで研究グループは、弱い化学的相互作用の効果を鋭敏に感知できるブルー銅タンパク質を用いました。ブルー銅タンパク質は、電子伝達タンパク質の一群で、電子の出し入れ(酸化還元反応)を担うタイプ1銅をタンパク質分子の内部に含んでいます。タイプ1銅の中心にある銅イオンと、銅イオンに直接結合しているアミノ酸残基の構造は、ブルー銅タンパク質の種類によらずよく似ていますが、光合成や脱窒呼吸といった異なる場面でも生物学的役割を担うことができるのは、その性質をタンパク質分子が巧みにコントロールしているためです。
本研究は特に、タイプ1銅の近傍である「第二配位圏(second coordination sphere)」に着目し、実験と計算の両面から第二配位圏の影響を評価することで、弱い化学的相互作用がブルー銅タンパク質の緒性質を精密に調節していることを突き止めました。
研究手法・成果
第二配位圏の弱い化学的相互作用の影響を捉えるために、放射光 X 線結晶構造解析によってブルー銅タンパク質の一種であるシュウドアズリンの構造を高精度に決定しました(図 1)。シュウドアズリンの第二配位圏には、本来メチオニン残基(Met)が存在し、側鎖の硫黄原子が銅イオンに結合するヒスチジン残基(His)に接近しています。メチオニンを人工的に他のアミノ酸残基に置き換えた変異体の場合には、代わりにフェニルアラニン(Phe)、ロイシン(Leu)、バリン(Val)、イソロイシン(Ile)の側鎖がヒスチジン残基に接近していました。この中で、フェニルアラニンやロイシンをもつ変異体は、もともと細菌から単離されるシュウドアズリン分子の中に、植物由来のブルー銅タンパク質の第二配位圏を再現したものです。
このような「細菌型」、「シダ植物型」、「高等植物型」とも呼べる第二配位圏の影響を詳しく調べるために、量子化学計算によって弱い化学的相互作用を可視化ました。計算によって得られた図 2 に見える緑色の部分は、第二配位圏とタイプ1銅の間に S−π、π−π、CH−π 相互作用が生じていることを示しています。また、第二配位圏にあるアミノ酸残基の種類によって、S−π、π−π、CH−π 相互作用の強さ(エネルギー)がわずかに変化し、シュウドアズリンの緒性質(分光学的・電気化学的性質や構造安定性)と密接に関係していることもわかりました。このことは、ブルー銅タンパク質の機能が第二配位圏によってコントロールされていることを裏付けていますが、他の金属タンパク質・金属酵素においても弱い化学的相互作用の影響を加味して第二配位圏を設計することで、本来の生物学的機能を損なわずに微調節できることを示しています。
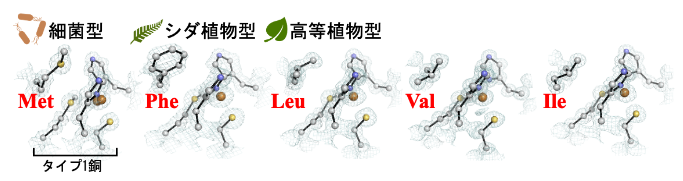
図1 X 線結晶構造解析で明らかにしたシュウドアズリンのタイプ1銅と第二配位圏アミノ酸残基(それぞれ Met、Phe、Leu、Val、Ile)の構造(解像度は 1.0-1.4 オングストロームで、1 オングストロームは100 億分の 1 メートル)
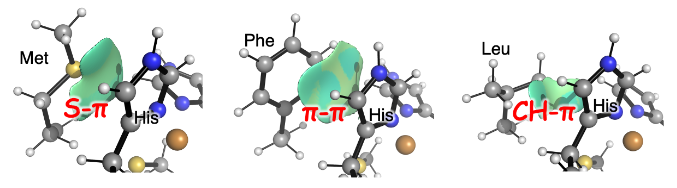
図2 量子化学計算によって可視化された、シュウドアズリン第二配位圏における弱い化学的相互作用の分布。第二配位圏のアミノ酸の種類によって S-π 相互作用、π-π 相互作用、CH-π 相互作用がそれぞれ見いだされた
今後の展望
本研究では、タンパク質におけるアミノ酸間の弱い化学的相互作用を実験的に特徴づけ、その影響を理論計算によって定量的に評価することにも成功しました。このような研究を基盤として、今後は、第二配位圏の影響を加味した酵素の制御技術の開発が大きく進展すると期待されます。また医薬品は、弱い化学的相互作用を通して薬剤分子がタンパク質に認識されることで効果を発揮しています。そのため、本成果によって得られたタンパク質における弱い化学的相互作用の理解は、生命現象の解明だけでなく、安全で有効な医薬品の効率的設計・開発の鍵となることが期待されます。
論文情報
タイトル:
Systematic elucidation of the second coordination sphere effect on the structure and properties of a blue copper protein, pseudoazurin
著者:
Takahide Yamaguchi, Attila Taborosi, Chihiro Sakai, Kohei Akao, Seiji Mori, Takamitsu Kohzuma*
雑誌:
Journal of Inorganic Biochemistry
公開日:
2023 年 6 月 15 日
DOI:
10.1016/j.jinorgbio.2023.112292
用語解説
(*1) 弱い化学的相互作用
分子骨格を形作る共有結合とは異なり、分子間や分子内で働く非共有結合性の相互作用。なかでも、水素結合や静電相互作用よりも弱く、分散力などに起因する。
(*2) 第二配位圏
金属イオンに直接結合する第一配位圏の配位子(アミノ酸残基)に隣接し、弱い化学的相互作用などを通して金属イオンに影響を及ぼす範囲


コメント