ポイント
- オートファジー関連(ATG)分子が構成する細胞内高次構造体の1つであるATG3~LC3複合体が、オートファジー機能を発揮するために膜と相互作用する詳細な分子メカニズムは不明でした。
- ATG3の両親媒性αヘリックスはユニークな物理化学的な性質を持っており、単なる膜結合だけではなく、オートファジー誘導時に生じるLC3分子の脂質化反応に必要な膜上でのATG3~LC3複合体のダイナミックな動態制御に関わっていることを明らかにしました。
- 細胞内の動的高次構造体と膜が相互作用する複雑な分子メカニズムを解析するための新たな方法論を提示するものであり、他の分子の制御機構解明への貢献が期待されます。
両親媒性αヘリックスによる膜上での ATG3〜LC3 複合体の動態制御
発表概要
東京大学大学院医学系研究科の西村多喜特任講師と水島昇教授らの研究グループは、オートファジー関連(ATG)分子(注 1)が構成する細胞内高次構造体の一つである ATG3~LC3 複合体(注2)が膜と相互作用する詳細な分子メカニズムを明らかにしました。膜相互作用に関与する領域として両親媒性αヘリックス(注 3)が知られていましたが、ATG3 の両親媒性αヘリックスが一般的なものと比べてユニークな物理化学的な性質があることを、教師なし機械学習(注 4)を用いた解析により見出しました。また、全原子分子動力学シミュレーション(注 5)や生細胞イメージング観察(注 6)により、ATG3~LC3 複合体が膜上でオートファジーにおける効率的な LC3 分子の脂質化反応に必要なダイナミックな挙動を示す動的な高次構造体であることや、ATG3 の両親媒性αヘリックスのユニークな性質がその動態制御に重要であることを明らかにしました。
本研究成果は細胞内の動的高次構造体と膜が相互作用する複雑な分子メカニズムを解析するための新たな方法論を提示するものであり、他の分子の制御機構解明への貢献が期待されます。
なお、本研究成果は米国時間 6 月 23 日に学会誌「Science Advances」に掲載されます。
発表内容
オートファジーは代表的な細胞内分解機構の一つであり、飢餓などに応答してオートファゴソームと呼ばれる二重膜構造が形成されるダイナミックな膜動態を伴う現象です。このオートファゴソームの形成にはオートファジー関連(ATG)分子が必要であり、これら ATG 分子の一部は複合体として ATG3~LC3 複合体などの高次構造体を形成し、膜結合モジュールである両親媒性αヘリックスを介してオートファゴソーム膜と結合することが知られています。両親媒性αヘリックスは一般的に曲率の高い膜領域と結合するという性質があることから、いずれの ATG分子も両親媒性αヘリックスを介して膜の曲率を感知して膜と結合していると考えられていました。しかしながら実際は、各 ATG 分子が必ずしも曲率の高い膜領域に局在するわけではなく、また膜に局在するタイミングも ATG 分子によって異なることから、どのように ATG 分子と膜との結合が制御されているのかはよく分かっていませんでした。
今回、研究グループは ATG 分子が膜上でどのように制御されているのかを明らかにするため、ヒト ATG3 の両親媒性αヘリックスに注目した解析を行いました。まずは、ATG3 以外の ATG 分子由来の両親媒性αヘリックスでも置換可能かどうか、ATG3 のキメラタンパク質(注 7)を作製し、レスキュー実験(注 8)により検証しました(図 1)。その結果、他の ATG 分子由来の両親媒性αヘリックスや、膜曲率を認識することがすでに示されている両親媒性αヘリックスではLC3 脂質化反応が十分に機能しないことが分かりました。その一方で、ハエや酵母など他の生物種 ATG3 由来の両親媒性αヘリックスは、アミノ酸配列が同一では無いのにも関わらず、いずれも十分に機能することが分かりました。この結果は、生物種に関わらず、ATG3 の両親媒性αヘリックスの重要な性質が高度に保存されていることを示唆しています。そこで次に、ATG3 両親媒性αヘリックスの特徴を見出すために、1800 以上の両親媒性αヘリックスのアミノ酸配列からアミノ酸組成や物理化学的性質などのパラメーターを算出し、教師なし機械学習を行いました。その結果、ATG3 両親媒性αヘリックスは、他の両親媒性αヘリックスと比べると、かさの大きな疎水性アミノ酸残基が少なく、疎水性が低いという特徴が共通してみられることが分かりました(図 2)。
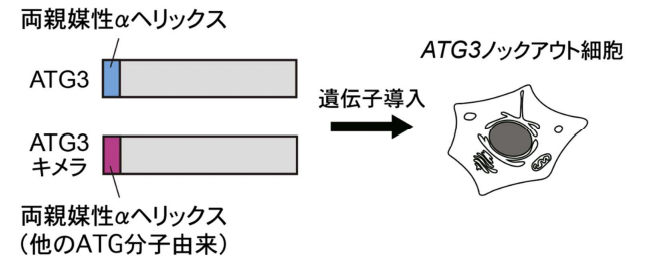
図 1:ATG3 キメラタンパク質を用いたレスキュー実験
ATG3 ノックアウト細胞の LC3 脂質化反応不全の表現型が ATG3 キメラの導入により回復するかどうか調べた。

図 2:教師なし機械学習による両親媒性αヘリックスの分類
各両親媒性αヘリックスのアミノ酸配列からアミノ酸組成や物理化学的性質などのパラメーターを算出し、主成分分析を行ったもの。PC1、PC2、PC3 はそれぞれ第 1、第 2、第 3 主成分軸。様々な生物種の ATG3 両親媒性αヘリックスが中央に集まって分布していることから、類似した特徴を有していることが分かる。
ATG3 は高次構造体である ATG3~LC3 複合体として膜と相互作用しますが、ATG3~LC3 複合体を生化学的に単離するのは技術的に困難であったため、全原子分子動力学シミュレーションを用いた解析を行うことにしました。その結果、ATG3~LC3 複合体は ATG3 の両親媒性 α ヘリックスと、ATG3 と LC3 を連結するチオエステル結合領域を介して、膜と一過的な相互作用をしていることが分かりました(図 3)。さらに、生細胞内での ATG3 の挙動を調べたところ、ATG3 とオートファゴソーム膜の相互作用は一過的であり、かさの大きな疎水性アミノ酸残基が少なく、疎水性が低いという特徴がこの一過的な相互作用を確かなものにしていることが明らかになりました(図 4)。

図 3:全原子分子動力学シミュレーションによる ATG3〜LC3 複合体と膜相互作用の解析
膜上での ATG3~LC3 複合体の挙動。左は LC3 が膜から離れているのに対し、右は LC3 が膜近傍に位置している。
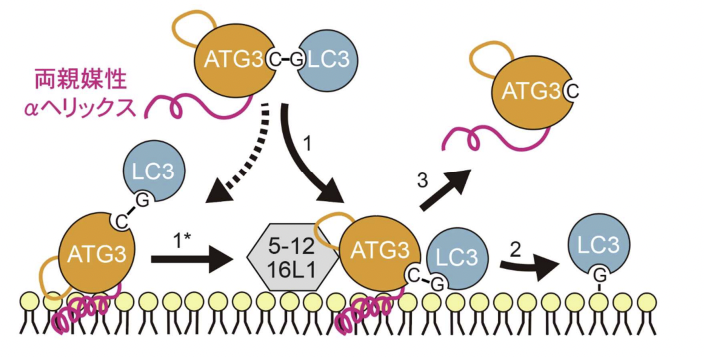
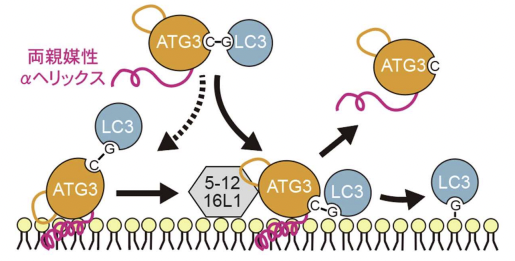
図 4:両親媒性 α ヘリックスによる膜上での ATG3〜LC3 複合体の動態制御
ATG3 による LC3 脂質化反応のモデル図。ATG3〜LC3 複合体が膜と結合すると(1)、LC3 脂質化が生じる(2)と共に、ATG3 は膜からすぐに離れ(3)、次の LC3 脂質化反応に利用される。ATG5-12-16L1 複合体は ATG3〜LC3 複合体を活性化することで(1,1*
)、LC3 脂質化反応を促進する。この一過的な膜相互作用は ATG3 の両親媒性 α ヘリックスのかさが小さく、疎水性が低いというユニークな性質によることが分かった。
今後は、今回示された ATG3 の両親媒性αヘリックスのユニークな性質が ATG3 特有のものなのかどうか明らかにしていく必要があります。また本研究は、細胞内の動的高次構造体と膜が相互作用する複雑な分子メカニズムを解析するための方法論として、様々な生物種のアミノ酸配列をもとに機械学習を用いる手法を新たに提示するものであり、他の分子の制御機構解明への貢献が期待されます。
発表者
東京大学大学院医学系研究科
西村 多喜(特任講師)<科学技術振興機構さきがけ専任研究者>
水島 昇(教授)
論文情報
〈雑誌〉Science Advances
〈題名〉Unique Amphipathic -helix Drives Membrane Insertion and Enzymatic Activity of ATG3
〈著者〉Taki Nishimura*¶ , Gianmarco Lazzeri , Noboru Mizushima, Roberto Covino,Sharon A. Tooze
*:筆頭著者
¶ :責任著者
〈D O I〉10.1126/sciadv.adh1281
〈U R L〉http://www.science.org/doi/10.1126/sciadv.adh1281
研究助成
本研究は、JST-さきがけ「動的なオルガネラコンタクトネットワーク制御機構の解明(JPMJPR20EC)」、学術変革領域 B「ポストリソソームシグナルを駆動する脂質因子の解析(21H05146)」、JST-ERATO「水島細胞内分解ダイナミクスプロジェクト(JPMJER1702)」、特別推
進研究「膜構造の分解を基軸とした細胞内分解の研究(22H04919)」、日本応用酵素協会研究助成の支援により実施されました。
用語解説
(注 1)オートファジー関連(ATG)分子
オートファジーに関連する遺伝子であり、これまでに Atg1 から Atg44 まで 40 種類以上のATG 分子が知られている。オートファジーが正常に起こるには各 ATG 分子によるタンパク質リン酸化や脂質輸送、LC3 分子の脂質化など、一連の様々な反応が生じる必要がある。ATG3 は LC3脂質化の最終ステップに関与する ATG 分子である。
(注 2)ATG3~LC3 複合体
ATG3 分子が LC3 分子とチオエステル結合することにより形成された反応中間体。このATG3~LC3 複合体がオートファゴソーム膜と相互作用することで LC3 脂質化反応が促進される。
(注 3)両親媒性αヘリックス
タンパク質の二次構造でαヘリックスを形成するもののうち、特に、疎水性アミノ酸残基が多い疎水性側と親水性アミノ酸残基が多い親水性側の二つの面があるものを指す。この構造的な特徴から全体として両親媒性の性質を示す。一般的に水溶液中では特定の構造を取らないが、脂質二重膜存在下では膜と相互作用してαヘリックスを形成する。
(注 4)教師なし機械学習
答えが事前に分かっていない大量のデータから隠れた構造や法則を見付け出す手法。主成分分析はその代表的なものの一つで、多数の特徴量を少数の特徴量で表現することを可能にする。
(注 5)全原子分子動力学シミュレーション
物質を構成する全ての原子に対してニュートンの運動方程式を解き、それらの軌跡を求める計算手法。脂質分子がどのような振る舞いをしているのかを解析する場合や、タンパク質と脂質の結合様式を予測する場合に非常に有用な解析手法の一つ。
(注 6)生細胞イメージング観察
蛍光タンパク質を付加した目的タンパク質を細胞に発現させて、細胞内での挙動を蛍光顕微鏡を用いて観察する方法。
(注 7)キメラタンパク質
遺伝子組み換え操作により、異なる遺伝子を混合して作製された人工タンパク質。
(注 8)レスキュー実験
特定の遺伝子が欠損したノックアウト細胞に現れた表現型が、野生型や変異体の遺伝子を導入することで表現型が回復するかを調べる実験。もし表現型を回復することができれば、その遺伝子が機能的であることを意味する。


コメント