発表のポイント
- ショウジョウバエにおいて、ネクローシスを伴う組織傷害部位で産生される過酸化水素が特定のセリンプロテアーゼを活性化し、自然免疫応答を誘導する可能性を示しました。
- これまで、組織傷害に応答した自然免疫の活性化に過酸化水素が関与することが報告されてきましたが、本研究は過酸化水素に応答しうるセリンプロテアーゼを特定することで、活性化機構への理解を前進させました。
- 動物種の約6割を占める昆虫から得られた組織傷害感知機構の発見は、自然免疫の更なる理解につながることが期待されます。
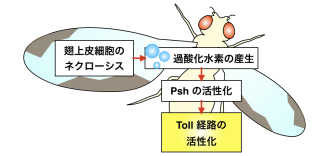
ネクローシスを伴う組織傷害に応答した Toll 経路活性化機構のモデル図
発表概要
東京大学大学院薬学系研究科の中野翔太郎大学院生(研究当時)、樫尾宗志朗助教、三浦正幸教授らによる研究グループは、無脊椎動物の代表的なモデル生物であるショウジョウバエで、翅にネクローシスを伴う組織傷害を誘導した際に自然免疫経路である Toll 経路(注 1)が活性化することに着目し、その分子機構の解析を行いました。感染時には体液中のセリンプロテアーゼカスケードが Toll 受容体に作用するリガンド Spätzle (Spz) を切断し成熟させることで、Toll 経路が活性化します。本研究グループはネクローシスに応答した非感染時の Toll 活性化も感染時と共通して Spz の成熟が必要であることを見出しました。さらに、培養細胞を用いた実験から Spz を成熟させるセリンプロテアーゼカスケードが活性酸素種の一種である過酸化水素に依存して活性化することを示しました。過酸化水素は傷害組織部位で産生される代表的なシグナル分子の一つです。ネクローシスを誘導した翅においても活性酸素種の産生が観察され、また、過酸化水素を除去する操作を行うことで、ネクローシスに応答した Toll 経路の活性化が抑制されることを見出しました。以上の結果は、ネクローシスを伴う組織傷害により生じた過酸化水素を感知することで、特定のセリンプロテアーゼが活性化し、Toll 経路を活性化することを示唆しています。
本研究は、自然免疫が自己成分を介して組織傷害を感知するメカニズムの一端を解明するものです。動物種の約6割を占める昆虫で、組織傷害に特徴的な過酸化水素を感知して自然免疫が活性化するメカニズムを見出したことで、進化的に発達してきた自己成分による新たな自然免疫活性化機構への理解が深まると期待されます。
〈研究の背景〉
自然免疫は脊椎動物から無脊椎動物に至るほとんど全ての多細胞生物に存在する重要な生体防御機構です。自然免疫のもつ大切な役割の一つは、細菌やウイルスなどの外来病原体を感知して排除するような感染応答ですが、自然免疫が生体内に生じた組織の傷害を感知して非感染性に活性化することも知られています。こうした非感染性の免疫応答は、傷害組織の修復などを通じて個体の恒常性維持に働くだけでなく、がんや神経変性疾患などの炎症性疾患の病態にも関与します。そのため非感染性の免疫活性化機構の解析は、ヒトを始めとした脊椎動物を中心に、Toll-like receptor (TLR) などの免疫関連受容体の活性化機構を軸にして進められてきました。その一方で、防御機構として自然免疫のみに頼る無脊椎動物では、傷害に応答した免疫活性化のメカニズムへの理解が立ち遅れています。研究グループは先行研究において、無脊椎動物の代表的なモデル生物であるショウジョウバエを用いて、翅上皮細胞のアポトーシス(注 2)を遺伝学的に阻害することで、ネクローシスを誘導できるモデルを確立しました。ネクローシスは組織傷害部位において観察される細胞死の一形態であり、非感染性の免疫応答を誘引することが知られています。このアポトーシス不全個体において、ネクローシスを伴う組織傷害に応答して自然免疫経路の一つである Toll 経路(哺乳類では TLR 経路に相当する。)が活性化することが我々の先行研究からわかっていました。しかしながら、組織傷害を感知してToll 経路が活性化する詳細な分子機構については不明な点が多く残されていました。
〈研究の内容〉
感染時のショウジョウバエの Toll 経路の活性化には、体液中のセリンプロテアーゼカスケードの活性化と、その下流で Toll リガンドである Spz が切断により活性化されることが必要です(図1)。そこで、まずネクローシスに応答した Toll 経路の活性化に Spz とその切断が必要であるかを、非切断型の spz 変異体を作出して検証しました。非切断型の spz 変異体では、ネクローシスに応答した Toll 活性化が抑制されたため、感染時と同様に Spz とその切断が必要であることが示されました。感染時の Spz の切断に至るセリンプロテアーゼカスケードは、感染を感知する上流のセリンプロテアーゼと、Spz 切断を実行する下流のセリンプロテアーゼで構成されます。このうち、カスケード上流のパラログなセリンプロテアーゼである Hayan とPersephone (Psh) の両方を欠損する変異体では、ネクローシスに応答した Toll 活性化が抑制されました。このことから、Hayan と Psh の両方がネクローシスを伴う組織傷害を感知して活性化し、Spz 切断を引き起こすことが示唆されました。先行研究において、組織の傷害部位で産生されるシグナル分子の一つである過酸化水素が Toll 経路の活性化を誘導することが報告されていました。そこで Spz と Psh をショウジョウバエの培養細胞で過剰発現し、培養液に過酸化水素を添加したところ、過酸化水素に依存して細胞内で Spz の切断が促進されました。この結果は、Psh が過酸化水素の下流で活性化し、Spz 切断を誘導する可能性を示唆します。さらに、ネクローシスを起こした翅で活性酸素種の産生が観察され、過酸化水素の消去に働く酵素であるカタラーゼをアポトーシス不全個体の全身で過剰発現したところ Toll の活性化が減弱しました。以上の結果から、アポトーシス不全個体では、ネクローシスの誘導により過酸化水素が産生され、それに応答した Psh の活性化を起点として、Spz 切断と Toll 経路の活性化が誘導される可能性が示唆されました(図2)。
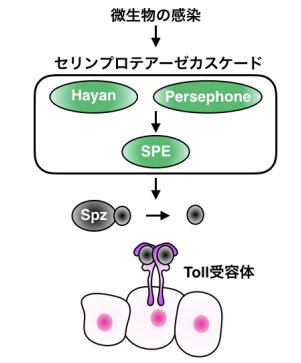
図 1:感染時のショウジョウバエ Toll 経路の活性化メカニズム
ショウジョウバエがグラム陽性細菌や真菌に感染すると体液中に存在するセリンプロテアーゼカスケードが活性化し、その下流で Toll 受容体のリガンド分子である Spätzle (Spz) が切断により活性化されます。感染時には、Hayan と Persephone (Psh) というパラログな2種類のセリンプロテアーゼがまず活性化し、その下流で Spz-processing enzyme (SPE) というセリンプロテアーゼを切断により活性化します。SPE は感染時にSpz を切断するセリンプロテアーゼです。切断された Spz が Toll 受容体に結合することで、細胞内へシグナルを伝達させます。
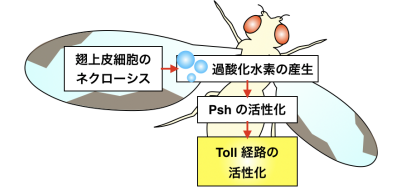
図 2:ネクローシスを伴う組織傷害に応答した Toll 経路活性化機構のモデル図
アポトーシス不全個体では、ネクローシスの誘導により組織傷害がおこり過酸化水素が産生されます。それに応答して Psh が活性化し、下流のプロテアーゼを介して Spz 切断と Toll 経路の活性化を誘導します。
〈今後の展望〉
自然免疫は多細胞生物全般に保存された基本的な生体防御機構です。しかしながら、ショウジョウバエのような無脊椎動物では、組織傷害に由来するどのような分子を、自然免疫がいかに感知するのかといった免疫活性化の起点となる分子基盤が未だ明らかにされていません。本研究では、ネクローシス細胞周辺で産生される過酸化水素によるセリンプロテアーゼ Psh の活性化が、Toll 経路活性化の起点となる可能性を示しました。過酸化水素は傷害の様式に関わらず産生されるシグナル分子であるため、過酸化水素を介した Psh 活性化は組織傷害全般に応答可能な分子機構として発達してきたと考えられます。今後、細胞内で過酸化水素が Psh を活性化する分子メカニズムや、老化、神経変性、がんモデルなどでも見られる組織傷害で同様のメカニズムが作動することを検証することで、進化的に保存された巧みな傷害感知による自然免疫の活性化機構への理解につながることが期待されます。
発表者
東京大学大学院薬学系研究科
中野 翔太郎(博士課程:研究当時)
樫尾 宗志朗(助教)
三浦 正幸(教授)
論文情報
〈雑誌〉 PLOS Genetics
〈題名〉 Damage sensing mediated by serine proteases Hayan and Persephone for Tollpathway activation in apoptosis-deficient flies
〈著者〉 Shotaro Nakano, Soshiro Kashio, Kei Nishimura, Asuka Takeishi, HinaKosakamoto, Fumiaki Obata, Erina Kuranaga, Takahiro Chihara, YoshioYamauchi, Toshiaki Isobe, and Masayuki Miura*
〈号〉 e1010761, 2023
〈D O I〉 https://doi.org/10.1371/journal.pgen.1010761
研究助成
本研究は、文部科学省科学研究費補助金基盤研究(S)「細胞死を起点とした細胞外コミュニケーションの発動と生理機能(研究代表者:三浦 正幸、課題番号:16H06385)」、基盤研究(A)「個体ごとの表現型を決める非細胞死カスパーゼ活性化機構の解明(研究代表者:三浦 正幸、課題番号:21H04774)」および学術変革領域(A)生体防御における自己認識の「功」と「罪」「無脊椎動物免疫センサーToll による自己免疫応答の分子機構と生理機能(研究代表者:三浦正幸、課題番号:23H04766)」の一環で行われました。
用語解説
(注 1)Toll 経路:ヒトにおける Toll 様受容体(TLR)経路と相同性のある自然免疫経路。グラム陽性細菌や真菌などの感染に応答して、細胞内で NF-κB(炎症や免疫応答などにおいて中心的役割を果たす転写因子のひとつ)を活性化することで免疫応答を惹起する。哺乳動物の TLR は細菌の細胞壁の構成因子であるリポ多糖を始め、多数の分子の構造パターンを認識して活性化するパターン認識受容体として働く。一方、ショウジョウバエの Toll 受容体はリガンドである Spz ファミリー分子と結合することで活性化するサイトカイン受容体である。Toll 経路はショウジョウバエの遺伝学的解析で見つかった自然免疫経路であり、2011 年ノーベル生理学・医学賞の受賞対象となった。
(注 2)アポトーシス:カスパーゼと呼ばれるシステインプロテアーゼが活性化して実行される細胞死で、プログラム細胞死で多く見られる。速やかに細胞が除去される際に、細胞の内容物を周囲に撒き散らすこと無く細胞が死ぬため、静かな、あるいはクリーンな細胞死と呼ばれる。線虫からヒトまで高度に保存された一群のカスパーゼ活性化経路を介しているため、ショウジョウバエにおいても遺伝学的に抑制することが可能である。


コメント